Ya en el año 1972 Lewis Thomas escribía en el NEJM los microorganismos que ingresan a nosotros, pasan a ser transeúntes. Es nuestra respuesta a su presencia lo que hace la enfermedad. Nuestros arsenales para destruir bacterias son tan poderosos, que nosotros estamos en mayor peligro que los invasores. En décadas posteriores, las ideas de Lewis Thomas llevaron a un cambio radical en el entendimiento de la sepsis por su teoría de que es la respuesta del hospedador la que provoca la enfermedad. Esta teoría deriva de un gran número de estudios experimentales, que eventualmente fueron cambiando la conceptualización de la sepsis que hasta entonces se tenía. Finalmente, el concepto actual fue introducido a la práctica clínica, cuando Roger Bone definió a la sepsis como un síndrome de respuesta inflamatoria sistémica (SRIS), que ocurre durante la evolución de una infección.
Recientemente en la reunión de consenso sobre sepsis se han introducido cambios en la definiciones operativas de la sepsis, los resultados y recomendaciones se conocen hoy como Sepsis-3. Estas recomendaciones que ya han sido expuestas previamente en este documento, deben pasar por el proceso de validación para poder ser adoptadas por todos los involucrados. Por el momento en este documento continuaremos mencionando algunos términos que se abandonan en Sepsis-3, pero que sin embargo siguen siendo utilizados ampliamente, por la comunidad médica y científica.
Recordando los criterios de SIRS propuestos en 1991 encontramos los siguientes criterios:
- Temperatura corporal>38 °C o < 36 °C.
- Frecuencia cardíaca>90 latidos por minuto.
- Frecuencia respiratoria > 20 respiraciones por minuto o evidencia de hiperventilación con una PaCO2< 32 mmHg.
- Recuento de leucocitos en sangre periférica>12.000/mm3 o < 4.000/mm3, o con presencia de neutrófilos inmaduros (bandas)59 > 10%.
Cuando el SIRS ha sido desencadenado por un proceso infeccioso se denomina sepsis.
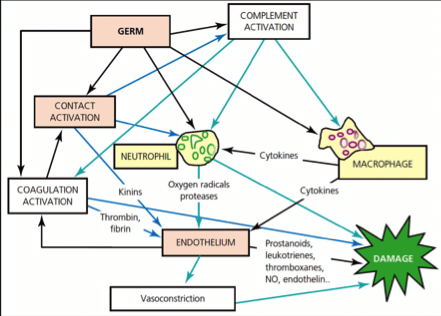
Los complejos mecanismos fisiopatológicos de la sepsis son desencadenados no sólo por la virulencia de los microorganismos sino también por la respuesta sistémica con generación de diferentes mediadores (gráfico 1).
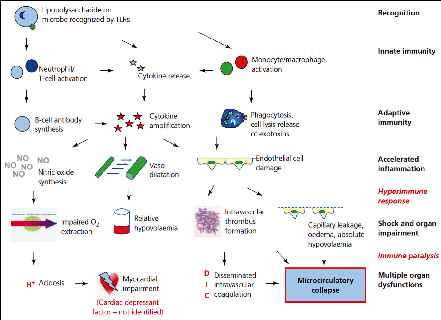
Las bacterias gram negativas han sido las más estudiadas por su frecuente relación causal con los fenómenos sépticos. El factor de virulencia más importante en estas bacterias es una endotoxina que forma parte de la membrana celular bacteriana, un lipopolisacárido que se libera hacia el torrente sanguíneo cuando hay lisis bacteriana. La respuesta inicial del huésped es la liberación de un reactante de fase aguda de producción hepática denominado proteína fijadora de lipopolisacárido. Esta proteína forma un complejo con el lipopolisacárido bacteriano lo que que cataliza la unión de éste al receptor CD14 en el macrófago, estimulando síntesis de citosinas pro-inflamatorias. La proteína fijadora de lipopolisacárido también tiene efectos de opsonización que facilitan la fagocitosis de bacterias gram negativas.
Normalmente la respuesta inmunitaria mantiene un delicado balance de autorregulación de tal manera que puede limitar las infecciones y a la vez promover la reparación celular y tisular. En este equilibrio están involucrados múltiples mediadores a saber: TNF-α, las IL 1 y 12, el interferón gamma, y señales antiinflamatorias, como IL 10, 4 y 6 y el factor de crecimiento transformador beta, el antagonista del receptor de interleucina 1 y algunas prostaglandinas.
Durante la sepsis las células endoteliales liberan trombomodulina y heparansulfato (cofactor para la antitrombina III), se incrementa la síntesis de factor tisular que impide la activación de proteína C y proteína S, siendo estas necesarias para la inactivación de la respuesta procoagulante, lo que provoca trombosis microvascular hipoperfusión celular, producción de lactato y disfunción orgánica múltiple.
En condiciones normales, la formación intravascular de trombos se encuentra regulada por un equilibrio entre los mecanismos protrombóticos y antitrombóticos (gráfico 2). Los principales mecanismos antitrombóticos dependen de la acción de la proteína C y S, la antitrombina y el inhibidor de la vía del factor tisular.
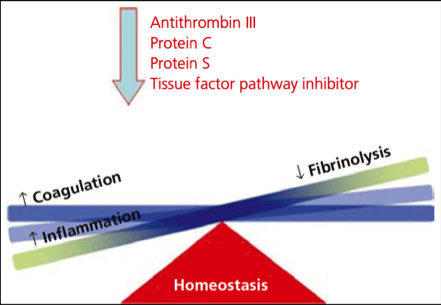
La trombina, formada en el proceso de la coagulación, está íntimamente implicada en la activación de la proteína C, iniciando un mecanismo de retroalimentación negativa que inhibe la formación de la trombina misma. La activación de la proteína C requiere la formación de un complejo entre la trombina y la trombomodulina, una proteína de membrana presente en la superficie endotelial. El complejo trombina-trombomodulina media a través de actividad catalizadora la activación de la proteína C a proteína C activada. Este proceso se acelera en la proximidad del receptor endotelial de la proteína C (EPCR). La proteína C activada en unión a su cofactor, la proteína S, hidroliza los factores Va y VIIIa, inhibiendo así la formación de complejos factor IXa-VIIIa (factor Xasa) y factor Xa-Va (protrombinasa), respectivamente.
Los procesos inflamatorios sistémicos llevan a un estado de vasodilatación generalizada que está determinado principalmente por el óxido nítrico (NO). El óxido nítrico (NO) se produce durante la conversión de L-arginina a L-citrulina por las isoformas de óxido nítrico sintetasa (NOS), este es un gas que modula varias funciones incluyendo la relajación del músculo liso, neurotransmisión, la citotoxicidad celular inmune, mecanismo de acción de agentes anestésicos y vías de nocicepción.
Como hemos mencionado el óxido nítrico es responsable del tono vasodilatador, esencial para la regulación de la presión arterial, una síntesis excesiva puede provocar y perpetuar la hipotensión resistente que vemos en el choque séptico. Las citocinas proinflamatorias estimulan la liberación endotelial masiva de esta sustancia al inducir la expresión de una isoforma, diferente de la habitual, de la enzima sintasa de óxido nítrico.
En condiciones fisiológicas, el óxido nítrico ejerce sus efectos mediante la activación de la fracción soluble de la enzima guanilato ciclasa, con el consiguiente aumento en la concentración del segundo mensajero guanosina monofosfato cíclico (cGMP). En el caso de producción aumentada de óxido nítrico, esté actúa de manera independientemente de la cGMP, ya sea aumentando la ribosilación de ADP en las proteínas plaquetarias, inactivando enzimas mitocondriales, o dañando el ADN, lo que se traduce en daño celular intenso irreversible en la microcirculación, lo que lleva a la vasodilatación generalizada y, por ende, a un estado de hipoperfusión generalizada que produce un estado de choque. (gráfico 3).
Las citosinas proinflamatorias pueden suprimir el eje hipotálamo-hipófisis-suprarrenal lo que puede originar insuficiencia suprarrenal relativa asociada con sepsis donde la expresión clínica más severa es la pobre respuesta a aminas vasopresoras.
Este artículo está basado en la tesina realizada por José Antonio Medina Hernández para el Máster en Anestesia, Sedación, Quirófano, Reanimación y Terapia del Dolor realizado en Formación Alcalá.


